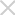近年来,在国家政策的大力引导下,我国新药研发领域不断向前迈进,成果瞩目。在此基础上,中国新药产品进入国际市场已成为必然趋势。对比研究加拿大、韩国、新加坡和马来西亚4个国家新药注册申请监管程序,以期为我国药品监管程序提供切实可行的建议,促进监管体制的完善。
2016年,我国相继颁布“重大新药创制”、“健康中国2030”等一系列规划及举措。在此推动下,新药研发领域取得了显著成绩。2016—2019年,国家药品监督管理局药品审评中心受理国产创新药注册申请数目分别为212件(77个品种)、402件(181个品种)、448件(222个品种)、528件(244个品种)。3年时间里我国创新药注册申请数目翻1倍。多年以来,我国一直同世界多个国家保持友好合作关系,互利往来,例如中国是亚太经济合作组织、中国-东盟自由贸易区、上海合作组织等国际组织的成员之一。新药在满足国内市场需求的同时,继而进入国际市场,期待惠及全球民众。中国药品进驻海外市场是新药研发领域蓬勃发展的新成果。近年来,我国对加拿大、韩国、新加坡和马来西亚药品出口额整体呈增长趋势,出口金额均在亿元以上(见图1),其中韩国是我国药品的主要出口目的地国家之一。随着“一带一路”的快速实施,开发沿线国家医药产品市场潜力较大。
通过对比加拿大、韩国、新加坡和马来西亚4个与我国有合作交流关系国家新药注册申请监管程序,促进国内药企对海外注册事务的认知,同时提炼出可供我国新药注册申请程序参考的借鉴点,助力监管部门完善监管体系建设。
1、新药注册申请申报资料格式对比
1.1 ICHCTD格式
通用技术文档是国际人用药品注册技术协调会为统一药品注册申报资料组织而撰写、发布的通用文件格式。CTD由5个模块(Module,M)组成,M1是区域性要求,M2~M5则基本上是全球内容标准统一。对于国际申报的产品而言,CTD格式可提高申请人编纂注册资料的效率,促进申请人与监管机构间的交流,有利于药政审批规程的标准化,进而加快药政审评审批过程。2003年7月,CTD成为欧盟和日本新药申请的强制格式。随着全球化标准的日益发展,如今较多国家和地区的新药注册申请都采用CTD格式,如中国、加拿大、新加坡、韩国等。
CTD格式在中国的应用相对较迟。2010年9月,原国家药品监督管理总局(CFDA)发布《化学药品CTD格式申报资料撰写要求》,接受化学药品注册分类3,4,5和6生产注册申请的药学部分申报资料按照CTD格式申报,同时提交电子版,可予以单独按序审评。2018年2月1日起,化学药品注册分类1类、5.1类以及治疗用生物制品1类和预防用生物制品1类注册申请适用CTD格式,CTD格式应用范围进一步扩大。2019年4月,国家药品监督管理局(NMPA)公布CTD格式模块1文件,于2019年7月1日开始实施。
浏览次数:176次浏览
优投平台部分资讯内容来自网络,转载已注明出处,如有勘误请您随时与我们联系YTservice@jiangtai.com,侵权立删。
 优投APP下载
优投APP下载 优投服务号关注
优投服务号关注